Zespół Pradera-Williego
Zespół Pradera-Williego (zespół Pradera-Labharta-Williego, ang. Prader-Willi syndrome, Prader-Labhart-Willi syndrome, PWS) – zespół wad wrodzonych spowodowany aberracją chromosomalną, najczęściej częściową utratą (delecją) długiego ramienia chromosomu 15, pochodzącego od ojca. Na obraz kliniczny choroby składają się niski wzrost, upośledzenie umysłowe, niedorozwój narządów płciowych (hipogonadyzm) oraz otyłość spowodowana mniejszym niż u zdrowych ludzi zapotrzebowaniem energetycznym przy jednoczesnym ciągłym niepohamowanym uczuciu głodu. Uważa się, że zespół Pradera-Williego jest najczęstszą genetycznie uwarunkowaną przyczyną otyłości
Historia
Przypuszczalnie jednym z pierwszych opisów choroby był ten pozostawiony przez Johna Langdona Downa, który w 1864 i ponownie w 1887 roku w słynnej monografii Mental Afflictions of Childhood and Youth opisał pacjentkę o inicjałach E.C., pensjonariuszkę Earlswood Asylum for Idiots, w wieku 14 lat ważącą 196 funtów (84 kg) przy wzroście 4 stóp i 4 cali (1,32 m). Jej chrapanie w nocy przeszkadzało innym pensjonariuszom, a w dzień była senna. Pacjentka miała także objawy hipogonadyzmu i charakterystycznie małe stopy i dłonie. W autopsji zmarłej przedwcześnie kobiety stwierdzono hipoplastyczne jajniki i macicę. Langdon Down dla opisu choroby użył terminu polysarcia, podobnie jak I.D. Hopkins w opisie z 1861 roku. Zachowane dane nie pozwalają jednak na ocenę tego ostatniego przypadku według przyjętych dziś kryteriów.
Nazwa choroby upamiętnia szwajcarskich lekarzy Andreę Pradera, Heinricha Williego i Alexisa Labharta, którzy w 1956 roku na łamach Schweizerische medizinische Wochenschriftopisali nowy zespół u dziewięciorga pacjentów z niskorosłością, opóźnieniem umysłowym, otyłością, oraz małymi dłońmi i stopami. W 1961 roku Prader i Willi opublikowali kolejną pracę, w której szczegółowiej przedstawili fenotyp nowo opisanego zespołu. Nazwa zespołu Pradera-Williego jest spotykana obecnie częściej niż nazwa zespołu Pradera-Williego-Labharta. W starszym piśmiennictwie spotyka się też zarzuconą nazwę zespołu HHHO (akronim głównych objawów zespołu: hypotonia-hypomentia-hypogonadism-obesity).
Mikrodelecje chromosomu 15 odkrył w 1981 David Ledbetter i wsp.. W 1983 Merlin Butler stwierdził, że delecja dotyczyła fragmentu chromosomu pochodzącego od ojca, a w 1989 Robert Nicholls wykazał obecność jednorodzicielskiej disomii w tych przypadkach, w których nie dało się stwierdzić delecji chromosomu ojcowskiego i zaproponował mechanizm imprintingu (piętnowania genomowego).
Epidemiologia
Częstość występowania zespołu ocenia się na 1:10 000-1:25 000 żywych urodzeń. Nie donoszono o różnicach w częstości PWS w różnych grupach etnicznych, jednak w jednej pracy wykazano, że fenotyp zespołu u Afroamerykanów może być mniej wyraźnie zaznaczony: dysmorfia twarzy łagodniej wyrażona, stopy i dłonie prawidłowej wielkości, a wzrost mniej wyraźnie obniżony. Autorzy pracy zasugerowali, że w populacji afroamerykańskiej PWS może być niedodiagnozowany. PWS jednakowo często dotyka obie płci.
| Autor | Kraj | Częstość/żywych urodzeń |
|---|---|---|
| Butler et al. | USA | 1:25 000 |
| Akefeldt et al. | Szwecja | 1:8 000 |
| Ehara et al. | Japonia | 1:15 000 |
| Oiglane-Shlik et al. | Estonia | 1:30 000 |
| Vogels | Flandria | 1:27 000 |
| Smith | Australia | 1:25 000 |
| Whittington et al. | Wielka Brytania | 1:45 000 |
Etiologia
Zespół Pradera-Williego spowodowany jest nieprawidłowością w regionie 15q11-q13, określanym jako region krytyczny zespołu Pradera i Williego (PWCR, Prader-Willi critical region) powstałą na skutek jednego z kilku mechanizmów:
- delecji fragmentu ojcowskiego chromosomu 15q11.2-q13 (około 70%)
- uniparentnej (jednorodzicielskiej – matczynej) heterodisomii (UPD, uniparental disomy) chromosomu 15
- mutacji imprintingowej (mikrodelecji w miejscu imprintingowym) przekazanej na chromosomie ojcowskim
- zrównoważonej rearanżacji chromosomalnej w obrębie 15q11.2-q13 (mniej niż 1%).
Nieprawidłowości w obrębie PWCR dotyczą ponad 99% pacjentów z fenotypem PWS.
Zespół Pradera-Williego był pierwszym opisanym u człowieka przykładem zjawiska imprintingu. Zespół Angelmana jest schorzeniem spowodowanym utratą matczynego fragmentu chromosomu obejmującego PWCR. Duplikacje PWCR powodują opóźnienie umysłowe, drgawki i autyzm.
PWS należy do grupy tzw. zespołów przyległych genów (contiguous gene syndromes), ponieważ fenotyp wynika z delecji kilku genów o sąsiadujących loci. W PWS delecji ulegają ojcowskie kopie genu SNRPN kodującego dwa białka: czynnik splicingowy SmN i polipeptyd SNURF (SNRPN upstream reading frame). SNRPN przepisywany jest też na długi, podlegający alternatywnemu splicingowi RNA, zawierający liczne, małe jąderkowe RNA (snoRNA, small nucleolar RNAs)[24]. W PWCR znajduje się też gen NDN kodujący nekdynę.
Model zwierzęcy
Przeprowadzono szereg badań na myszach, które pozwoliły zaproponować mechanizmy patogenezy schorzenia u ludzi. W jednym z nich mysz z mutacją wewnątrzgenową genu Snrpn była fenotypowo normalna, co sugerowało, że mutacje ludzkiego genu SNRPN nie są wystarczające do wywołania fenotypu PWS. Myszy z większymi delecjami obejmującymi zarówno Snrpn jak i domniemane centrum imprintingu (PWS-IC) nie wykazywały ekspresji piętnowanych genów Zfp127 (mysi ortolog ZNF127), Ndn i lpw, a ich fenotyp wykazywał podobieństwo do obrazu klinicznego PWS u ludzkich noworodków. W jednym z najnowszych badań poddano delecji region krytyczny zawężony do klastra genów MBII-85 kodujących małe jąderkowe RNA (snoRNA). Myszy dziedziczące allel po matce (PWScrm−/p+) są nieodróżnialne od myszy dzikiego typu; wszystkie myszy z odziedziczonym allelem po ojcu (PWScrm+/p−) wykazywały opóźnienie wzrostu i 15% śmiertelność w okresie pourodzeniowym.
Czynniki ryzyka
Niemal wszystkie przypadki PWS są sporadyczne, co oznacza, że zespół nie jest dziedziczony. Opisywano przypadki rodzinnego występowania, przyjmuje się jednak, że ryzyko wystąpienia PWS u kolejnego dziecka jest rzędu 0,1% (patrz: Poradnictwo genetyczne).
Wykazano, że narażenie ojca na działanie węglowodorów w okresie okołokoncepcyjnym wiąże się ze zwiększeniem ryzyka wystąpienia PWS u dziecka. W jednym retrospektywnym badaniu stwierdzono, że około połowa ojców dzieci z PWS była narażona na te mutageny w związku z wykonywaną pracą.
Objawy kliniczne i przebieg
Charakterystyczne objawy w zespole Pradera-Williego to:
- hipotonia mięśniowa (obniżenie napięcia mięśni) w okresie prenatalnym objawia się słabymi ruchami płodu, brakiem postępu akcji porodowej; utrzymuje się u niemowląt i małych dzieci, napięcie mięśniowe poprawia się około 2–4. roku życia; z hipotonią wiąże się słaby odruch ssania i trudności w karmieniu. PWS jest jednym z zespołów predysponujących do ułożenia pośladkowego płodu;
- opóźniony rozwój psychoruchowy;
- hipogonadyzm hipogonadotropowy, manifestujący się jako hipogenitalizm (niedorozwój narządów płciowych), małe prącie, mała, hipoplastyczna, niepomarszczona moszna o słabej pigmentacji (zabarwieniu skóry), jednostronne lub obustronne wnętrostwo (80-90%);
- nadmierne łaknienie (hiperfagia) i wynikające z niej nadwaga i otyłość. Szczegółowe badanie zachowania pacjentów z PWS pozwoliło zasugerować, że istotą hiperfagii nie jest nadmierny głód, tylko zahamowanie uczucia sytości;
- zmieniona budowa (cechy dysmorficzne) twarzy: węższe czoło, antymongoloidalne ustawienie szpar powiekowych, "migdałowaty" kształt szpar powiekowych, skierowane do dołu kąciki ust, małe i trójkątne usta ("rybie"), wąska czerwień wargowa górnej wargi. Dysmorfia twarzy może być bardzo delikatna lub nieobecna u noworodka i ewoluować z wiekiem;
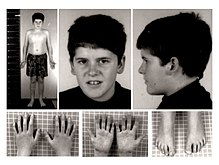
- małe dłonie i stopy (akromikria), zwężające się ku końcom palce;
- zez zbieżny;
- niezwykle gęsta ślina, zwiększająca podatność na próchnicę i stwarzająca problemy przy anestezjologicznej kontroli pracy dróg oddechowych podczas zabiegów operacyjnych;
- wysoki próg odczuwania bólu;
- skłonność do hipertermii;
- opóźnienie rozwoju mowy; później mogą wystąpić zaburzenia artykulacji;
- zmiany zachowania – dzieci z PWS mogą być kapryśne, uparte, czasem agresywne, skłonne do wybuchów złości, zachowań obsesyjno-kompulsyjnych i psychoz; typowym zachowaniem jest skubanie skóry (ang. skin picking), nieraz poważnie utrudniające gojenie się ran pooperacyjnych
- niezwykłe zdolności poznawcze u pacjentów wykazujących jednocześnie opóźnienie umysłowe: opisywano zamiłowanie do układania puzzli i szczególną umiejętność zapamiętywania czytanego tekstu;
- zaburzenia snu, bezdech nocny;
- hipopigmentacja skóry, tęczówek i włosów, wynikająca z tyrozynazo-dodatniego albinizmu (około 30%);
- niski wzrost (niskorosłość), spowodowany niedoborem hormonu wzrostu;
- wady ośrodkowego układu nerwowego (szczególnie mózgu): poszerzenie układu komorowego (wentrikulomegalia, do 100%), zmniejszona objętość płatów ciemieniowych i potylicznych (50%), spłycenie bruzdy Sylwiusza (60%), niecałkowite zamknięcie wyspy (65%).
| Ciąża i poród | Okres noworodkowy i niemowlęcy | Dzieciństwo | Dojrzewanie i dorosłość |
| Zmniejszona aktywność ruchowa płodu Ułożenie pośladkowe Poród przedwczesny lub po czasie | Wąskie czoło Niezstąpione jądra Małe narządy płciowe zewnętrzne i jądra Słabe napięcie mięśni Problemy z karmieniem Słaby odruch ssania Lepka ślina Cichy płacz Zmienna temperatura ciała Opóźnienie w rozwoju | Niskorosłość Małe dłonie i stopy Jasna skóra i tęczówki Migdałowate szpary powiekowe Zez Krótkowzroczność Skubanie skóry Próchnica zębów Nadmierny apetyt/ szukanie jedzenia Otyłość Deficyt intelektualny Zaburzenia zachowania (napady złości, upór, zachowania obsesyjno-kompulsyjne) | Niskorosłość Małe dłonie i stopy Skolioza Osteoporoza Opóźnione dojrzewanie płciowe Cukrzyca Depresja Nadmierna senność |
Powikłania
Powikłania otyłości są główną przyczyną zgonu pacjentów z PWS. Należą tu:
- niewydolność krążeniowo-oddechowa
- cukrzyca
- zespół bezdechu sennego
- zakrzepowe zapalenie naczyń
- obrzęki nóg
- ostre rozdęcie żołądka, mogące skutkować jego martwicą.
Rozpoznanie
Opracowano kryteria diagnostyczne dla PWS. Dla dzieci w wieku do 3 lat do rozpoznania wystarcza 5 punktów, z czego co najmniej 4 za kryteria duże; dla dzieci w wieku powyżej 3 lat rozpoznanie wymaga 8 punktów, z czego co najmniej 5 za kryteria duże. Kryteria dodatkowe jedynie zwiększają lub zmniejszają pewność postawionej diagnozy:
Kryteria duże (1 punkt każde):
- Hipotonia mięśniowa w okresie noworodkowym i wczesnodziecięcym, ze słabo wykształconym odruchem ssania i ustępująca w miarę dorastania.
- Problemy z karmieniem i (lub) niechęć do ssania w niemowlęctwie, wymuszające konieczność specjalnych technik karmienia.
- Szybki wzrost masy ciała między 1. a 6. rokiem życia powodujący otyłość centralną.
- Hiperfagia, obsesja na punkcie jedzenia, szukanie jedzenia.
- Charakterystyczne cechy dysmorficzne twarzy (dolichocefalia w niemowlęctwie, wąski wymiar czołowy, migdałowate szpary powiekowe, skierowane w dół kąciki ust – wymagane przynajmniej 3).
- Hipogonadyzm (hipoplazja narządów płciowych, małe wargi sromowe mniejsze u dziewcząt, hipoplastyczna moszna i wnętrostwo u chłopców; niecałkowite lub opóźnione dojrzewanie płciowe; niepłodność).
- Opóźnienie rozwoju psychoruchowego, łagodne do średniego opóźnienie umysłowe, trudności w uczeniu się u dziecka <6. roku życia.
- Delecja 15q11-13 stwierdzona w badaniu cytogenetycznym wysokiej rozdzielczości (>650 prążków), lub inna nieprawidłowość chromosomu w PWSCR, w tym matczyna disomia
Kryteria małe (0,5 punktu każde):
- Obniżone ruchy płodu, letarg płodu, poprawa z wiekiem.
- Zaburzenia zachowania u dziecka (zmiany nastroju, zachowania obsesyjno-kompulsyjne, upór, skłonność do kradzieży i kłamstwa).
- Zaburzenia snu/ okresy bezdechu.
- Niskorosłość w wieku 15 lat (przy niewdrożeniu terapii GH; należy wziąć pod uwagę wzrost rodziców).
- Hipopigmentacja skóry i włosów w porównaniu do reszty rodziny.
- Małe i wąskie dłonie (<25 percentyla), małe stopy (<10 percentyla) – sprawdzane na siatkach centylowych.
- Zez zbieżny, krótkowzroczność.
- Wydzielanie gęstej i lepkiej śliny, zbierającej się w kącikach ust.
- Zaburzenia artykulacji.
- Nawykowe skubanie skóry.
Kryteria dodatkowe:
- Wysoki próg bólu.
- Osłabiony odruch wymiotny.
- Skolioza (w zależności od wieku występuje u 30–80% osób z zespołem) i (lub) kifoza.
- Wczesne adrenarche.
- Osteoporoza.
- Niezwykłe zamiłowanie do układania puzzli.
- Prawidłowe wyniki badań nerwowo-mięśniowych (biopsji mięśnia, EMG, NCV).
Metody cytogenetyczne
Rozpoznanie kliniczne PWS powinno być potwierdzone cytogenetycznie. Dostępne metody to:
- analiza metylacji DNA
- metoda FISH
- techniki oparte na markerach mikrosatelitarnych
| Metoda | Rozpoznawane mutacje | Odsetek pacjentów |
| Analiza metylacji | Nieprawidłowa metylacja DNA | 99% |
| FISH/Ilościowe metody PCR | Delecja PWCR | 70% |
| Badania w kierunku UPD | UPD regionu PWCR | 25% |
| Sekwencjonowanie | Defekt centrum imprintingu | <1% |
Różnicowanie
- Czaszkogardlak i efekty jego leczenia wywołują obraz kliniczny najbardziej pokrywający się z fenotypem PWS; uszkodzenie podwzgórza przez guz, zabieg neurochirurgiczny albo radioterapię, zwłaszcza w młodym wieku, wywołuje niskorosłość i zaburzenia łaknienia. Dawniej zespół objawów wynikających z uszkodzenia podwzgórza rozpoznawano jako dystrofię tłuszczowo-płciową albo podwzgórzycę.
- Hiperfagiczna niskorosłość (hyperphagic short stature) jest nabytym stanem związanym z psychospołecznym stresem skutkującym niedoborem GH, hiperfagią i zaburzeniami poznawczymi.
Hipotonia w okresie noworodkowym wymaga uwzględnienia w diagnostyce różnicowej następujących chorób:
- zespołu Downa;
- depresji ośrodkowego układu nerwowego;
- wrodzonej dystrofii miotonicznej typu 1;
- zaniku rdzeniowego mięśni;
- rzadkich zespołów spowodowanych aberracjami chromosomalnymi -
dup Xq27.2-ter, del q16.2, del 1p36, del 10q26; - zespołu Angelmana;
- zespołu łamliwego X;
- zespołu Retta.
Opóźnienie rozwoju psychoruchowego, otyłość i hipogonadyzm występują w takich zespołach jak:
- jednorodzicielska disomia chromosomu 14;
- wrodzona osteodystrofia Albrighta – występuje niskorosłość, ale nie stwierdza się hipotonii, a dysmorfia twarzy jest odmienna (okrągła twarz);
- zespół Bardeta-Biedla;
- zespół Cohena – charakterystyczna dysmorfia twarzy (krótka rynienka podnosowa, mikrocefalia, ciężkie opóźnienie umysłowe);
- zespół Börjesona-Forssmana-Lehmana – chorują mężczyźni, znaczenie różnicujące mają mikrocefalia, ciężkie opóźnienie umysłowe, charakterystyczne grube rysy twarzy, głęboko osadzone oczy, ptoza.
Zespoły podobne do PWS z przykurczami stawowymi w obrazie klinicznym:
- zespół Urbana-Rogersa-Meyera;
- zespół Camery-Marugi-Cohena;
- zespół Vasqueza.
Leczenie
Nie ma metody leczenia przyczynowego PWS. Dowiedziono, że korzystne efekty daje terapia hormonem wzrostu, poprawiająca stosunek tkanki mięśniowej do tłuszczowej i pozwalająca na normalizację wzrostu. Obecnie, PWS jest obok zespołu Turnera i somatotropinowej niedoczynności przysadki, wskazaniem do standardowego leczenia GH. W Polsce program terapii GH objął dzieci z zespołem Pradera-Williego w 2006 roku. Terapia wymaga jednoczesnej diety, ograniczania dostępu do jedzenia i intensywnej rehabilitacji. Leczenie zostaje przerwane gdy wystąpią przeciwwskazania (np. cukrzyca), w przypadku zakończenia wzrastania, braku rehabilitacji.
- Terapie eksperymentalne
Podejmowano próby chirurgicznego leczenia pacjentów z PWS, przez wytworzenie zespolenia omijającego żołądek sposobem Roux-en-Y. Chirurgiczne możliwości obok gastroplastyki obejmują jeszcze wagotomię, są jednak stosunkowo mało skuteczne.
Leki teoretycznie mogące poprawić gospodarkę lipidową pacjentów z PWS: orlistat i tiazolidynediony, nie mają do tej pory sprawdzonej skuteczności.
Rokowanie
Jakość życia pacjentów z PWS jest znacznie obniżona i zazwyczaj osiągana długość życia jest krótsza niż średnia w populacji. Jednak postępy w prowadzeniu chorych z PWS przyczyniły się w ostatnich latach do wydłużenia oczekiwanej długości życia; opisano przypadki zgonów pacjentów z PWS w wieku 71 i 68 lat.
Poradnictwo genetyczne
Większość chorych z PWS jest niepłodnych i nie wymaga konsultacji genetycznej pod kątem ryzyka urodzenia chorego potomstwa. W większości przypadków ryzyko wystąpienia PWS u kolejnych dzieci rodziców dziecka z PWS jest małe, zależy jednak od typu choroby i może sięgać nawet 50%. Informacje podsumowane są w tabeli:
| Mechanizm genetyczny | Ryzyko |
| Delecja PWCR | <1% |
| UPD | <1% |
| Defekt imprintingu i mutacja | ≤50% |
| Defekt imprintingu bez mutacji | <1% |
| Translokacja zrównoważona powstała de novo | <1% |
| Odziedziczona translokacja zrównoważona. | 25% |
Zespół Pradera-Williego w Polsce
Według danych Polskiego Stowarzyszenia Pomocy Osobom z Zespołem Pradera-Williego, w Polsce istnieje ponad 100 stwierdzonych przypadków występowania zespołu Pradera-Williego. Choroba jest mniej znana szerokiemu społeczeństwu. W 2012 na łamach ogólnopolskiego pisma „KnC” (10 tys. nakładu) zaczął publikować felietony Staś, chory na PWS.
Zespół Pradera-Williego w kulturze
Za najstarsze przedstawienie zespołu Pradera-Williego uważane są dwa obrazy hiszpańskiego malarza barokowego Juana Carreño de Mirandy (1616–1685), La Monstrua vestida i La Monstrua desnuda, przedstawiające dziewczynkę o imieniu Eugenia Martinez Vallejo, przebywającą wówczas na dworze króla Karola II i przezywaną "La Monstrua" z powodu monstrualnej otyłości. Podobno dr Andrea Prader po zobaczeniu obrazów w madryckim Museo del Prado od razu rozpoznał charakterystyczne cechy PWS.
Zauważono też, że Joe sportretowany w Klubie Pickwicka Dickensa ma wiele cech zespołu Pradera i Williego






Brak komentarzy:
Prześlij komentarz