Stwardnienie guzowate
Stwardnienie guzowate (choroba Bourneville’a-Pringle’a , łac. sclerosis tuberosa, morbus Bourneville-Pringle, epiloia, ang. tuberous sclerosis, tuberous sclerosis complex, TS, TSC) – rzadka, wielonarządowa choroba uwarunkowana genetycznie, należąca do grupy fakomatoz, powodująca zmiany w nerkach, sercu, gałkach ocznych, mózgu, płucach i skórze, często związana z niepełnosprawnością intelektualną i padaczką. Stwardnienie guzowate zostało opisane jako nowa jednostka chorobowa w 1880 roku przez Désiré’a-Magloire’a Bourneville’a. Przez ostatnie dwa dziesięciolecia dokonał się znaczny postęp w wiedzy o tej chorobie, związany z odkryciem jej genetycznego podłoża – mutacji w genach TSC1 i TSC2. Stwarza on nowe możliwości skutecznej terapii stwardnienia guzowatego.
.
Historia
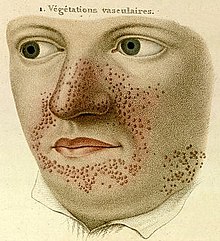
Pierwsze opisy stwardnienia guzowatego pochodzą z XIX wieku i wiążą się z rozkwitem wiedzy o chorobach skóry przypadającym na ten okres. W 1835 francuski dermatolog Pierre François Olive Rayer opublikował atlas chorób skóry, w którym przedstawił 400 różnych jednostek chorobowych, w tym prawdopodobnie stwardnienie guzowate pod nazwą végétations vasculaires.
W 1850 angielscy dermatolodzy, Thomas Addison i William Gull opisali kolejny przypadek, 4-letniej dziewczynki z charakterystyczną wysypką w okolicy nosa i obydwu policzków, opisaną przez nich jako vitiligoidea tuberosa. Kolejnym, który opisał chorobę, był niemiecki patolog Friedrich Daniel von Recklinghausen. Opisany przez niego w 1862 przypadek noworodka, który zmarł zaraz po porodzie, nie został jednak uznany przez niego jako odrębna jednostka chorobowa, raczej jako patologiczno-anatomiczna ciekawostka. Sekcja noworodka wykazała obecność licznych guzów mięśnia sercowego, z których jeden miał rozmiary „gołębiego jaja”. Recklinghausen określił te guzy jako myomata, ponadto stwierdził liczne stwardnienia w mózgu. W 1881ten sam autor opisał inną fakomatozę, nazwaną później jego imieniem (choroba von Recklinghausena).
Z 1880 pochodzi pierwszy, klasyczny opis choroby autorstwa francuskiego neurologa Désiré’a-Magloire’a Bourneville’a. Jego pacjentka, 15-letnia Marie, prezentowała opóźnienie psychoruchowe, padaczkę, połowiczy niedowład kurczowy, charakterystyczne zmiany skórne na nosie, policzkach i czole (rozpoznane mylnie przez Bourneville’a jako trądzik różowaty) i małe włókniaki na karku. Objawy neurologiczne ujawniły się w niemowlęctwie, w wieku lat 3 trafiła do szpitala, gdzie jej choroba została określona jako nieuleczalna. 7 maja 1879 roku zmarła w szpitalnym łóżku. Sekcja wykazała twarde, lite guzy zakrętów mózgu, nazwane przez Bourneville’a sclérose tubéreuse des circonvolution cérébrales. Wprowadzona nazwa choroby pochodziła od greckich słów tuber, oznaczającego bulwę lub ziemniaka, i skleros, znaczącego „twardy”. Uznał on, że te zmiany w mózgowiu były bezpośrednią przyczyną drgawek. Ponadto, stwierdzono białawe masy w obu nerkach.
W roku 1881 kolejny przypadek, dwuletniego dziecka które zmarło w stanie padaczkowym, opisał niemiecki lekarz Hartdegen z kliniki w Lipsku. Jako pierwszy przeprowadził badanie histologiczne tkanki mózgowej chorego na TSC; badanie post mortem ujawniło małe guzki w komorach bocznych mózgu i obszary stwardnienia kory mózgu, w których mikroskopowo stwierdził obecność dużych zwojopodobnych komórek – określił je mianem glioma gangliocellulare cerebri congenitum. W tym samym roku Bourneville wraz z Édouardem Brissaudem opisał podobne zmiany u zmarłego 4-letniego chłopca ze stwardnieniem guzowatym, u którego objawy pojawiły się już w 4 miesiącu życia i spowodowały poważne upośledzenie umysłowe. Francuzi opisali guzowate zmiany kory mózgu, małe, twarde guzki w ścianie komór mózgu i małe guzy w miąższu nerek. Do 1889 roku Bourneville opisał jeszcze dziesięcioro pacjentów ze stwardnieniem guzowatym.
Z 1885 pochodzi kolejne doniesienie o zmianach skórnych w TSC, autorstwa Felixa Balzera i Pierre’a Eugene’a Menetriera; zmiany te określono jako gruczolaki gruczołów łojowych skóry twarzy i głowy (adénomes sébacés de la face et du cuir), co jak wiadomo dzisiaj, nie jest prawdą. Szkocki dermatolog John James Pringle przedstawił opis 25-letniej kobiety z obniżoną inteligencją, zmianami skórnymi rąk i nóg oraz charakterystyczną, grudkową wysypką na twarzy. Pringle odnalazł też w literaturze trzy wcześniejsze doniesienia i dotarł do dwóch niepublikowanych. Termin adenoma sebaceum przyjął się w medycynie zamiennie z eponimem guzków Pringle’a albo choroby Pringle’a (skórne objawy stwardnienia guzowatego).
Następne lata przyniosły więcej opisów choroby, a kolejni lekarze dodawali objawy do obrazu klinicznego chorób: Bourneville’a i Pringle’a , ponieważ związek między tymi chorobami nie był jeszcze dostatecznie ustalony. W 1901 Giovanni Battista Pellizzi opisał dokładnie patologię układu nerwowego w TSC, opisując ich dysplastyczny charakter i ubytki demienilizacyjne w ich obrębie. Richard Kothe w tym samym czasie odnotował obecność włókniaków okołopaznokciowych u chorych, odkrycie jednak zapomniane i przypisywane Joannesowi Koenenowi, który opisał je przeszło trzydzieści lat później (od niego wzięły też nazwę). Paul Schuster w 1914 roku jako pierwszy opisał ognisko skóry szagrynowej jako objaw TSC, a znamiona bezbarwne pozostawały niezdiagnozowane aż do 1932 roku, gdy zwrócili na nie uwagę Critchley i Earl. W 1924 Henry Marcus pierwszy stwierdził charakterystyczny obraz zwapnień okołokomorowych w radiogramie u chorych ze stwardnieniem guzowatym.
Zmiany na dnie oka u chorych na stwardnienie guzowate opisał dokładnie w 1920 Jan van der Hoeve, który nadał im nazwę phacoma i powiązał stwardnienie guzowate z innymi chorobami: chorobą von Hippla-Lindaua i wspomnianą już chorobą von Recklinghausena, wprowadzając pojęcie fakomatozy. W 1908 roku niemiecki neurolog Heinrich Vogt podał kryteria diagnostyczne TSC, definitywnie łącząc objawy neurologiczne i dermatologiczne w jednym opisie choroby. Przez wiele lat podana przez Vogta triada objawów epilepsja–idiotyzm–adenoma sebaceum była w użyciu, dopiero w latach 60. stwierdzono, że mniej niż 1/3 pacjentów wykazuje wszystkie trzy objawy. Kolejnym istotnym odkryciem było stwierdzenie, że TSC jest chorobą genetyczną. Dokonał tego Kirpicznik w 1910 roku, który opisał przypadki bliźniąt jedno- i dwujajowych oraz jedną rodzinę w której trzy kolejne pokolenia chorowały na stwardnienie guzowate. Przed nim Pringle, Balzer i Menetrier odnotowali rodzinne występowanie zmian skórnych charakterystycznych dla stwardnienia guzowatego. Dziedziczenie choroby w trzech generacjach jednej rodziny opisał Berg w 1913 roku. Edward Alfred Cockayne w 1933 roku zwrócił uwagę na dominujący sposób dziedziczenia TSC, a po nim podobne obserwacje ogłosili Gunther i Penrose.
W 1911 roku Edward Sherlock przedstawił dziewięć przypadków choroby, i stworzył termin epiloia (kontaminacja greckich słów epilepsia i anoia, z których drugie oznacza upośledzenie umysłowe). Termin został raczej zarzucony i jest rzadko używanym synonimem TS. W 1981 genetyk Robert James Gorlin podał użyteczny akronim EPILOIA pozwalający zapamiętać najważniejsze objawy choroby – epilepsy, low inteligence, and adenoma sebaceum. Z 1918 roku pochodzi pierwszy opis limfangioleiomiomatozy u pacjentki z TS, autorstwa René Lutembachera.
Epidemiologia
Stwardnienie guzowate spotykane jest we wszystkich grupach etnicznych i rasowych, jednakowo często u obu płci. Szacunki co do częstości choroby znacznie się różnią; kiedyś stwardnienie guzowate uważane było za niezmiernie rzadkie, obecnie, wraz z postępem w diagnostyce i rosnącą wiedzą na temat choroby, liczba rozpoznań rośnie. W latach 50. częstość oceniano na 1:150 000, obecnie proponuje się 1:6800-1:17 30. Oznacza to, że na tę chorobę na całym świecie choruje około 2 milionów osób.
| Australia | 1:150 000 | Dawson, 1954 |
| . | 1:20 000 | Paulson i Lyle, 1966 |
| . | 1:100 000 | Nevin i Pearce, 1968 |
| Polska | 1:23 000 | Zaremba, 1968 |
| Chiny | 1:170 000 | Singer, 1971 |
| Populacja zachodniej Szkocji do 12 roku życia | 1:12 000 | Sampson, 1989 |
| Olmsted County, Minnesota | 1:15 000 | Shepherd et al, 1991 |
| Zachodnia Szwecja, dzieci od 1. do 15. roku życia | 1:6800 | Ahlsen et al, 1994 |
Patogeneza
Odkrycie przyczyny choroby
Przełomem w badaniach nad genetyką TSC było odkrycie Fryera ze współpracownikami z 1987 roku, którzy wykazali, że gen stwardnienia guzowatego dziedziczy się łącznie z grupami krwi AB0. Pozwoliło to określić prawdopodobne locus genu TSC na długim ramieniu 9 chromosomu, w pobliżu locus dla grup krwi AB0. Ponieważ wielu chorych nie wykazywało zmian w tym locus, kilka zespołów badawczych zaczęło poszukiwać dodatkowych genów zaangażowanych w patogenezę TSC. W 1992 roku opublikowano w Nature Genetics ich wspólną pracę, dowodzącą istnienia locus choroby na 16 chromosomie. Region 16p13.3 był już zmapowany przez badaczy szukających genu APKD1 związanego z wielotorbielowatością nerek typu 1, więc szybko odkryto gen TSC2 odpowiedzialny za postać TSC związaną z chromosomem 16. Dopiero dekadę po odkryciu locus na chromosomie 9 ostatecznie zidentyfikowano gen TSC1, o czym doniósł międzynarodowy zespół naukowców na łamach Science w sierpniu 1997 roku.
Etiologia
Choroba spowodowana jest mutacją z utratą funkcji w genach TSC1 albo TSC2. W 2/3 przypadków jest to sporadyczna mutacja, u pozostałych pacjentów dziedziczenie jest autosomalne dominujące. Produkt białkowy genu TSC1 zlokalizowanego na 9. chromosomie (9q34) to hamartyna, gen TSC2 ma locus na 16. chromosomie i koduje tuberynę. Z tym samym locus wiąże się jedna z postaci zespołu wielotorbielowatych nerek; duże delecje u 2% pacjentów z mutacją TSC2 powodują wystąpienie objawów obu tych chorób. Obydwa geny – TSC1 i TSC2 są genami supresorowymi. Mechanizm patogenezy stwardnienia guzowatego jest analogiczny do tego opisanego przez Knudsona w przypadku siatkówczaka(teoria „dwóch uderzeń”) i polega na spontanicznej mutacji w drugim allelu i utracie funkcji genu. Być może wyjątkiem są guzy kory mózgowej, w których patogenezie postuluje się mechanizm haploinsuficjencji. Nie potwierdzono doniesień o związku choroby z loci 12q (OMIM 191091) i 11q (OMIM 191090). Hamartyna i tuberyna funkcjonują w komórce jako kompleks Rheb-GTPazy zaangażowany w regulację podziałów komórkowych, hamujący szlak sygnalizacyjny mTOR. Mutacje w którymkolwiek z genów TSC1 albo TSC2powodują, że kompleks jest nieaktywny, podziały komórek są zaburzone, a to z kolei sprzyja powstawaniu guzów nowotworowych.
Somatyczne mutacje w genie TSC1 odpowiadają za sporadyczną limfangioleiomiomatozę. (OMIM#606690) i powstawanie naczyniakomięśniakotłuszczaków nerek. Mutacje w genie TSC1 są też wiązane z ogniskową dysplazją korową Taylora (OMIM#607341).
Somatyczne mutacje w genie TSC1 odpowiadają za sporadyczną limfangioleiomiomatozę. (OMIM#606690) i powstawanie naczyniakomięśniakotłuszczaków nerek. Mutacje w genie TSC1 są też wiązane z ogniskową dysplazją korową Taylora (OMIM#607341).
| Cecha | TSC1 | TSC2 |
|---|---|---|
| OMIM | OMIM*605284 | OMIM*191092 |
| Locus | 9q34 | 16p13.3 |
| Wielkość genu | 55 kb | 44 kb |
| Liczba egzonów | 23 (21 kodujących) | 42 (41 kodujących) |
| Wielkość transkryptu | 8.6 kb (4.5 kb 3'UTR) | 5.4 kb |
| Białko | Hamartyna | Tuberyna |
| Wielkość cząsteczki białka | 1164 aminokwasów, 130 kDa | 1807 aminokwasów, 180 kDa |
| Procent wykrywalności mutacji | 12-19% | 65-70% |
| Rozmieszczenie mutacji | Cały gen (kilka regionów częściej, ale bez gorących miejsc mutacji) | Cały gen (kilka regionów częściej, ale bez gorących miejsc mutacji) |
| Typy mutacji | Typu nonsens, przesunięcia ramki odczytu, mutacje na złączach intron/ekson | Typu missens, delecje w obrębie ramki odczytu, duże delecje/rearanżacje dotyczące genu PKD |
Pozakomórkowy czynnik wzrostu wiąże się z receptorem błonowym, co aktywuje kinazę fosfoinozytydu (PI3K), która z kolei fosforyluje 4,5-bisfosforan fosfatydyloinozytolu (PIP2) do 3,4,5-trifosforanu fosfatydyloinozytolu (PIP3) (fosforylację hamuje białko PTEN). Proces ten stwarza kinazie białkowej Akt miejsce wiązania do błony komórkowej, gdzie kinaza Akt jest aktywowana na drodze fosforylacji przez 3-fosfatydyloinozytydozależną kinazę białkową 1 (PDK1). Kinaza Akt hamuje kompleks TSC1/TSC2 przez fosforylację cząsteczki tuberyny. Kompleks hamartyna/tuberyna ma aktywność białka aktywującego GTPazy (GAP): aktywuje GTPazę katalizującą przejście kompleksu GTP-Rheb do Rheb-GDP. Białko mTOR (ssaczy cel rapamycyny, mammalian target of rapamycin) tworzy kompleks z białkami raptor (białko związane z regulacją mTOR, akronim od ang. Regulatory associated protein of mTOR) i GβL. Rheb-GTP aktywuje kompleks mTOR-raptor prowadząc do fosforylacji przez tę kinazę białek S6K (kinazy rybosomalnej S6) i białka wiążącego eukariotyczny czynnik inicjacji transkrypcji (4E-BP1), aktywując pierwsze białko i hamując drugie. W rezultacie prowadzi to do syntezy białek i wzrostu komórki. Na schemacie zaznaczono potwierdzone mechanizmy regulacji kompleksu hamartyna/tuberyna i białka Rheb: niski poziom ATP w komórce i obecność AMP aktywuje reakcję kinazy LKB1 fosforylującej kinazę aktywowaną przez AMP (AMPK), która z kolei fosforyluje tuberynę zwiększając aktywność GAP kompleksu hamartyna/tuberyna; hipoksja poprzez białko REDD1 również aktywuje kompleks hamartyny/tuberyny, podczas gdy aktywowane mitogenami kinazy ERK1/2 i RSK1 hamują go. Lek rapamycyna wiąże się z kompleksem mTOR/raptor/GβL zmniejszając jego aktywność. Symbol P oznacza przyłączaną przez kinazy resztę fosforanową.
Objawy i przebieg
Zmienność obrazu klinicznego w stwardnieniu guzowatym jest bardzo duża, nawet w obrębie jednej rodziny. Wiele objawów pojawia się w miarę rozwoju dziecka. Nierzadka jest poronna postać choroby (forme fruste). Zmiany narządowe w stwardnieniu guzowatym mają charakter zaburzeń rozwojowych typu hamartoma, hamartia, hamartoblastoma (rzadko) i choristoma, a na podłożu niektórych z nich rozwijają się nowotwory złośliwe, zwłaszcza mózgu i nerek.
Ośrodkowy układ nerwowy
Obrazowanie MRI czaszki wykazuje nieprawidłowości u 80-95% pacjentów z TSC. Większość tych zmian lokalizuje się nad namiotem móżdżku, znacznie rzadziej zmiany stwierdza się podnamiotowo. W klasycznym obrazie choroby w mózgowiu obecne są następujące rodzaje zmian:
- podwyściółkowe guzki okołokomorowe (ang. subependymal (heterotopic) nodules) – guzki pod wyściółką układu komorowego, nierzadko wapniejące. Zwapnienia są szczególnie dobrze widoczne w obrazach uzyskanych w tomografii komputerowej, ale widać je także w obrazach MRI T1- i T2-zależnych jako obszary obniżonego sygnału. Historycznie, w badaniu pneumoencefalograficznym guzki prezentowały się objawem „okapującej świecy” (ang. „candle guttering” sign). Guzki podwyściółkowe typowo występują w ścianach komór bocznych, ale znajdowano je we wszystkich przestrzeniach komorowych mózgowia; wykazują predylekcję do umiejscowienia w okolicy otworu międzykomorowego Monro.
- guzy korowo-podkorowe (guzki korowo-podkorowe, ang. cortical/subcortical tubers) – hamartomatyczne, guzowate zmiany w korze lub pod nią. Obecnie określenie guzów (cortical tubers) rezerwuje się dla dysplastycznych zmian zakrętów mózgowia o twardej, guzowatej spoistości, zwykle występujących na wierzchołku zakrętu. Guzy typowo występują w zakrętach kory mózgu, ale zdarzają się też guzy kory móżdżku. Guzy korowo-podkorowe stwierdzano już u płodu w 20. tygodniu ciąży. Uważa się, że zmiany te stanowią wyraz zaburzonej migracji komórek nerwowych w przebiegu rozwoju układu nerwowego. Traktuje się je łącznie ze zmianami mniej odgraniczonymi i widocznymi nieraz tylko mikroskopowo jako zaburzenia architektury kory i określa razem jako ogniskową korową dysplazję. W MRI zmiany te w obrazach T1-zależnych dają niski sygnał, a w obrazach T2-zależnych i sekwencji FLAIR silny. Niekiedy ulegają degeneracji torbielowatej, ale nigdy transformacji nowotworowej. Badania kliniczne dowodzą, że istnieje korelacja między dużą liczbą guzów (>7) u pacjentów ze stwardnieniem guzowatym a wystąpieniem w niemowlęctwie drgawek i opornej na leczenie padaczki; liczba guzów byłaby niezależnym czynnikiem rokowniczym dla ewentualnego upośledzenia umysłowego.
- gwiaździak podwyściółkowy olbrzymiokomórkowy (ang. subependymal giant cell astrocytoma, SEGA). Guz rozwija się z ulegających transformacji złośliwej guzków podwyściółkowych, zazwyczaj w głowie jądra ogoniastego, w sąsiedztwie otworu międzykomorowego Monro, co nierzadko skutkuje wodogłowiem; nowotwór ten rozwija się u 6-14% chorych z TSC. Szczytowy okres pojawienia się gwiaździaka przypada na okres 8-18 roku życia.
- heterotopie istoty białej mózgu (ang. white matter linear migration lines) – częste (przy starannej ocenie widoczne na obrazach MRI T2-zależnych u 20-30% pacjentów), ale dyskretne zmiany mające postać pasm przebiegających od guzków podwyściółkowych w kierunku powierzchni kory mózgu (albo guza korowo-podkorowego) bądź od prawidłowej ependymy do guzowatej zmiany w korze mózgu.
Rzadsze zmiany w ośrodkowym układzie nerwowym stwierdzane u pacjentów z TSC to częściowa (ale nie całkowita) agenezja ciała modzelowatego, rozległa dysplazja kory mózgu powodująca nawet hemimegalencefalię, agenezja albo hipoplazja półkul móżdżku bądź robaka móżdżku.
Zmianom narządowym towarzyszą objawy neurologiczne. U 70-90% pacjentów występują napady padaczkowe, z których pierwsze pojawiają się zwykle w pierwszym roku życia i mają charakter napadów zgięciowych (zespół Westa). U ponad połowy chorych występuje opóźnienie rozwoju psychoruchowego lub umysłowego. Częste są zaburzenia neurobehawioralne, takie jak autyzm, schorzenia ze spektrum autyzmu czy ADHD. Duże badanie na 108 pacjentach z TSC wykazało, że padaczka występuje u 80% z nich, a opóźnienie umysłowe u 44%, z czego u 2/3 upośledzenie umysłowe było ciężkie (IQ<21).
Nerki
Od 75 do 85% pacjentów z TSC posiada łagodne hamartomatyczne guzy nerek – naczyniakomięśniakotłuszczaki (angiomyolipomata) (w niektórych źródłach określane jako choristoma, a w innych jako nowotwory łagodne). Wielkość guzów powyżej 3 cm (według niektórych autorów, powyżej 4 cm) wiąże się z dużym ryzykiem potencjalnie groźnego dla życia samoistnego krwotoku (zespół Wünderlicha). Od 20 do 30% pacjentów z TSC ma torbiele nerek, u 2-3% rozwija się wielotorbielowatość nerek. Obecność naczyniakomięśniakotłuszczaków nerek wiąże się z nieco zwiększonym (2 do 3%) ryzykiem raka jasnokomórkowego nerki; nowotwór rozwija się wcześniej u pacjentów z TSC w porównaniu z resztą populacji. Ponadto częściej niż w populacji występują inne typy raka nerki – brodawkowaty (carcinoma papillare), chromofobny (carcinoma chromophobicum) i onkocytoma. Naczyniakomięśniakotłuszczaki charakteryzują się zwiększoną skłonnością do krwawień, dlatego każdy zabieg i biopsja guza musi odbywać się przy zachowaniu odpowiednich środków ostrożności ze strony lekarza.
Wątroba
W wątrobie również występują naczyniakomięśniakotłuszczaki, których częstość powyżej 10. roku życia wynosi około 40-50%. Zazwyczaj przebiegają bezobjawowo.
Skóra i błony śluzowe
Zmiany skórne w stwardnieniu guzowatym są bardzo różnorodne:
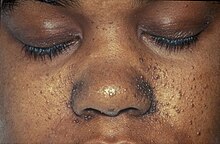
- u pacjentów występują na twarzy tzw. guzki Pringle’a , których liczba wzrasta z wiekiem. Zmiany te określane kiedyś jako gruczolaki łojowe (adenoma sebaceum), histologicznie są raczej naczyniakowłókniakami (angiofibroma) i nie mają związku z gruczołami łojowymi; są to małe, żółtoróżowe grudki różnej wielkości, na ogół nie zlewające się ze sobą, zajmujące symetrycznie okolice łojotokowe: nos i przyśrodkowe części policzków. Niektórzy autorzy uważają je za patognomoniczne dla TSC. Zwykle pojawiają się w wieku około 5 lat, w późniejszym okresie wymagają różnicowania z trądzikiem młodzieńczym;
- włókniaki płaskie okolicy czołowej (ang. fibrous plaques) – spotykane u 15-20% chorych, głównie u starszych dzieci, ale mogą pojawić się też u niemowląt. Histologicznie również są to angiofibromata;
- uszypułowane włókniaki okolicy karkowej i szyjnej – nie są charakterystyczne dla stwardnienia guzowatego;
- plamy barwnikowe koloru kawy z mlekiem (café au lait) – pojedyncze, płaskie i dobrze odgraniczone plamy, zlokalizowane głównie na tułowiu i kończynach; występują dopiero po okresie dojrzewania, więc ten objaw jest bardziej typowy dla choroby Recklinghausen'a.
- plamy odbarwione w kształcie liścia (ang. leaf-shaped leukoderma), znamiona bezbarwne – występują u ponad 90% chorych, mają więc dużą wartość diagnostyczną. Często widoczne są dopiero w świetle lampy Wooda, chociaż trudności może sprawiać rozróżnienie ich od odbarwień innego pochodzenia. Plamy zlokalizowane w obrębie owłosionej skóry głowy albo powiek powodują odbarwienie pasma włosów bądź rzęs (poliosis);
- plamy typu „confetti” (ang. „confetti” lesions) – są odmianą znamion bezbarwnych, zwykle spotykaną u osób dorosłych. Mają postać niewielkich (około 2–3 mm średnicy) plamek na skórze powierzchni wyprostnych kończyn, głównie przedramion i podudzi;
- plamy szagrynowe (ang. shagreen patches) w okolicy krzyżowej i grzbietowej części tułowia – u około 20-30% pacjentów, mogą nie występować u młodszych dzieci. Większość z nich ma średnicę od kilku do kilkunastu milimetrów i uniesioną, nierówną powierzchnię;
- włókniaki okołopaznokciowe palców dłoni i stóp, tzw. guzki Koenena – są to różowe lub czerwonawe guzki, często mnogie, pojawiają się dopiero w okresie pokwitania albo u osób dorosłych.
- na dziąsłach spotykane są brodawkowate wyrośla, również będące włókniakami. Nierzadkie są zmiany przerostowe dziąseł, zwykle jednak udaje się stwierdzić związek ich wystąpienia z wcześniejszym przyjmowaniem preparatów fenytoiny.
Narząd wzroku
W siatkówce występują guzki hamartomatyczne, określane dawniej jako phacomata albo neurocytophacomata; histologicznie są to hamartomata astrocytarne (ang. retinal astrocytic hamartomas). Zazwyczaj są bezobjawowe. W badaniu oftalmoskopowym mają obraz szarobiałych guzków; stwierdzane są w każdym wieku, także u noworodków. Mnogie guzki siatkówki są uważane przez niektórych autorów za patognomoniczne dla stwardnienia guzowatego. Można wyróżnić trzy ich rodzaje:
- płaskie, półprzezroczyste, słabo odgraniczone od otoczenia (ang. flat, translucent lesions),
- guzki typu „owocu morwy” (multinodular „mulberry” lesions),
- guzki „mieszane” (transitional type lesions).
Częstość guzków hamartomatycznych siatkówki w jednym z badań określono na 44%; najczęstsze były guzki płaskie (70%), guzki typu „owocu morwy” stanowiły 55%, do typu pośredniego zakwalifikowano 9% guzków. Inne zmiany narządu wzroku spotykane u pacjentów z TSC to krótkowzroczność, dalekowzroczność, astygmatyzm, zez, przegrupowanie barwnika siatkówki (areas of retinal depigmentation), naczyniakowłókniaki powiek, koloboma i, jako powikłanie wodogłowia, obrzęk tarczy nerwu wzrokowego.
Płuca
U pacjentów z TSC mogą wystąpić zmiany w miąższu płuca, polegające na rozplemie komórek zbliżonych do mięśniowych wokół oskrzeli, naczyń krwionośnych i chłonnych, prowadzącym do obturacji dróg oddechowych i torbielowatej destrukcji płuc, co określa się jako limfangioleiomiomatozę (lymphangioleiomyomatosis, LAM). Limfangioleiomiomatoza może być związana z TSC (TS-LAM) albo sporadyczna, spowodowana somatycznymi mutacjami genu TSC1 w tkankach układu oddechowego. Choroba występuje niemal wyłącznie u kobiet i zwykle jest diagnozowana u młodych dorosłych; na podstawie badań radiologicznych stwierdzono częstość limfangioleiomiomatozy u pacjentek ze stwardnieniem guzowatym na 26-39%. Ostatnie badania potwierdzaja hipotezę, że zmiany te w TSC są w istocie przerzutami z nerkowych naczyniakomięśniakotłuszczaków, które zawsze współistnieją u pacjentów ze zdiagnozowaną limfangioleiomiomatozą. Objawami choroby mogą być odma opłucnowa, narastająca duszność wysiłkowa, kaszel, krwioplucie. W RTG stwierdza się zazwyczaj rozdęcie płuc, zmiany siateczkowate, siateczkowato-guzkowe i małe torbiele. Często choroba przebiega jednak bezobjawowo. Wynik badania tomografii komputerowej albo MRI wykazuje obecność cienkościennych, okrągławych torbielek w obu płucach. Niekiedy choroba płuc jest na tyle poważna, że może wymagać przeszczepu płuc. Według danych z Mayo Clinic limfangioleiomiomatoza była trzecią, po patologiach nerek i mózgu, przyczyną zgonu pacjentów ze stwardnieniem guzowatym.
Poza limfangioleiomiomatozą, w miąższu płuc pacjentów z TSC stwierdza się niekiedy wieloogniskową mikroguzkową hiperplazję pneumocytów (ang. multifocal micronodular pneumocyte hyperplasia, MMPH). Jest to rodzaj łagodnego rozrostu pneumocytów typu 2 (komórek Clary), które tworzą małe guzki widoczne radiologicznie, ale bezobjawowe. Ponadto, u chorych na stwardnienie guzowate mogą powstawać jasnokomórkowe guzy (tzw. guzy „cukrowe”, ang. „sugar” tumors), które również są asymptomatyczne, i niekiedy tylko uciskają oskrzele.
Serce
W mięśniu sercowym u około 50% pacjentów pediatrycznych z TSC stwierdza się mięśniaki prążkowanokomórkowe (rhabdomyomata). U noworodków częstość może być jeszcze większa i sięgać 70-90%. Guzy te często są bezobjawowe, ale mogą też dawać objawy w postaci zaburzeń rytmu serca. Niezwykłą cechą tych guzów jest ich samoistne ustępowanie zwykle po 2. roku życia. W jednym z badań u 20 na 24 pacjentów stwierdzono całkowitą regresję nowotworu. Mogą być zdiagnozowane w USG płodu i są najczęstszym guzem serca rozpoznawanym in utero. Mięśniaki mogą być związane z niewydolnością serca u noworodka, u około połowy pacjentów z rhabdomyomawystępują zaburzenia rytmu (tachykardia pochodzenia przedsionkowego, tachykardia pochodzenia komorowego, całkowity blok serca, zespół Wolffa-Parkinsona-White’a). Niektóre badania sugerują, że wielkość guzów serca zależy od wpływów hormonalnych (częstsze są w okresie pokwitania u dziewcząt). U dorosłych chorych ze stwardnieniem guzowatym są rzadkie.
Przewód pokarmowy
U pacjentów ze stwardnieniem guzowatym stwierdzono dużą częstość polipów jelita grubego; szacuje się ją na 70-75% wśród dorosłych chorych. Donoszono również o kazuistycznych przypadkach polipowatości żołądka u chorych z TSC. Zmiany w jelicie grubym są bezobjawowe i nie są obarczone ryzykiem zezłośliwienia, stąd ich rozpoznanie w badaniu kolonoskopowym ma jedynie znaczenie w diagnostyce stwardnienia guzowatego (stanowią kryterium mniejsze).
Kości
Zmiany torbielowate w kościach ujęte są w kryteriach rozpoznawania choroby jako kryterium mniejsze.
Trzustka
Obok naczyniakomięśniakotłuszczaków donoszono o złośliwych zmianach nowotworowych, zwłaszcza typu guza insulinowego, w miąższu trzustki chorych z TSC.
Zęby
Stosunkowo niedawno wykazano, że w stwardnieniu guzowatym charakterystyczne są zmiany w szkliwie. Ich częstość u chorych z typowo przebiegającym TSC w jednym z badań wyniosła 71%. Zmiany te określa się jako „dołkowatą” hipoplazję szkliwa (ang. pitted enamel hypoplasia). Zasugerowano, że obecność tej cechy u krewnych pacjentów z pełnoobjawowym stwardnieniem guzowatym może świadczyć o występowaniu u nich poronnej postaci choroby.
Zmienności
U poszczególnych osób ze stwardnieniem guzowatym może wystąpić różna część spośród powyższych zmian; od braku zmian, do niemal wszystkich znanych. Poniższa tabela podaje częstość występowania niektórych objawów klinicznych u osób ze zdiagnozowanym stwardnieniem guzowatym.
.
Patomorfologia
Poza gwiaździakiem podwyściółkowym olbrzymiokomórkowym pozostałe zmiany (naczyniakomięśniakotłuszczaki, guzy siatkówki, mięśniaki prążkowanokomórkowe serca, zmiany skórne) nie są w zasadzie nowotworami, ale zaburzeniami rozwojowymi. Jest przedmiotem kontrowersji, jaki dokładnie mają charakter: zmiany te określa się jako hamartoma, hamartia, hamartoblastoma albo choristoma. Zestawienie tych informacji wraz z podsumowaniem możliwych zmian narządowych w TSC znajduje się w tabeli.
| Narząd | Zmiany typu hamartia | Zmiany typu hamartoma |
|---|---|---|
| Mózgowie | Guzy korowo-podkorowe | Guzki podwyściółkowe okołokomorowe Gwiaździak podwyściółkowy olbrzymiokomórkowy |
| Skóra | Plamy hipomelanotyczne | Naczyniakowłókniaki twarzy Włókniaki płaskie czoła Włókniaki okołopaznokciowe Plamy szagrynowe |
| Nerka | Torbiele nerek | Naczyniakomięśniakotłuszczaki nerek |
| Serce | Mięśniaki prążkowanokomórkowe | |
| Płuca | Limfangioleiomiomatoza | |
| Trzustka | Gruczolak z komórek wysp trzustki | |
| Jelito | Hamartomatyczne polipy na granicy okrężnicy i odbytnicy | |
| Nadnercze | Naczynikomięśniakotłuszczaki nadnerczy | |
| Tarczyca | Gruczolak tarczycy płodowy albo brodawkowaty | |
| Jądro | Naczyniakomięśniakotłuszczak jądra | |
| Zęby | Hipoplazja szkliwa | |
| Kości | Torbiele paliczków | Stwardnienie pokrywy czaszki (ang. calvarial sclerosis) |
| Naczynia krwionośne | Defekty ściany tętnic, tętniaki |
Poszczególne zmiany narządowe z reguły nie wymagają potwierdzenia histopatologicznego; najnowsze kryteria zalecają potwierdzenie w przypadku podejrzenia hamartoma wątroby, śledziony albo trzustki.
Rozpoznanie
| Kryteria większe | ||||
|---|---|---|---|---|
| Lokalizacja | Objaw | Wiek wystąpienia | Uwagi | |
| 1 | Głowa | Angiofibromata twarzy lub płaskie włókniaki okolicy czoła | Niemowlęctwo – dorosłość | |
| 2 | Palce dłoni i stóp | Niepourazowe, okołopaznokciowe włókniaki (guzki Koenena) | Pokwitanie – dorosłość | |
| 3 | Skóra | Plamy hipomelanotyczne | Niemowlęctwo – dzieciństwo | Więcej niż 3 |
| 4 | Skóra | Plamy szagrynowe (znamiona łączące) | Dzieciństwo | |
| 5 | Mózg | Guzy korowe mózgu | Życie płodowe | 5 i 15 razem liczone jako jedno kryterium większe. |
| 6 | Mózg | Guzki podwyściółkowe mózgu | Dzieciństwo – pokwitanie | |
| 7 | Mózg | Podwyściółkowy gwiaździak olbrzymiokomórkowy | Dzieciństwo – pokwitanie | |
| 8 | Gałka oczna | Liczne guzkowate zmiany hamartomatyczne siatkówki | Niemowlęctwo | |
| 9 | Serce | Rhabdomyoma serca | Życie płodowe | Pojedyncze lub mnogie |
| 10 | Płuca | Limfangioleiomiomatoza | Pokwitanie – dorosłość | |
| 11 | Nerki | Naczyniomięśniakotłuszczak nerki (angiomyolipoma) | Dzieciństwo – dorosłość | 10 i 11 razem liczone jako jedno kryterium większe. |
| Kryteria mniejsze | ||||
| Lokalizacja | Objaw | Uwagi | ||
| 12 | Zęby | Liczne losowo rozmieszczone dołki w szkliwie | ||
| 13 | Odbytnica | Hamartomatyczne polipy odbytnicy | Sugerowane jest potwierdzenie histopatologiczne. | |
| 14 | Kości | Torbiele kości | ||
| 15 | Mózg | Ogniska migracji istoty białej mózgu | Wystarczające jest rozpoznanie radiologiczne. 5 i 15 razem liczone jako jedno kryterium większe. | |
| 16 | Dziąsła | Włókniaki dziąseł | ||
| 17 | Wątroba, śledziona i inne narządy | Hamartoma (pozanerkowe) | Sugerowane jest potwierdzenie histopatologiczne. | |
| 18 | Gałki oczne | Obszar siatkówki pozbawiony barwnika | ||
| 19 | Skóra | Ogniskowe zmiany skórne typu „confetti” | ||
| 20 | Nerki | Liczne torbiele nerki | Sugerowane jest potwierdzenie histopatologiczne. | |
Rozpoznanie TSC standardowo stawiane jest na podstawie zmienionych kryteriów Gomeza ustalonych na TSC Consensus Conference w Annapolis, Maryland w 1998 roku (tabelka). Diagnozę TSC uważa się za definitywną, gdy spełnione są dwa większe kryteria albo jedno większe i dwa mniejsze; możliwą, gdy spełnione jest jedno większe i jedno mniejsze kryterium; podejrzenie TSC ma miejsce, gdy spełnione jest tylko jedno większe kryterium albo dwa lub więcej kryteriów mniejszych.
Nie ma patognomonicznych dla TSC objawów, co oznacza, że rozpoznanie musi uwzględniać liczne objawy, często nieuchwytne w niespecjalistycznym badaniu lekarskim. W rozpoznaniu konieczne jest badanie dermatologiczne, neurologiczne, okulistyczne (badanie dna oka), kardiologiczne (echokardiografia) i badania obrazowe – tomografia komputerowa mózgu, tomografia albo USG narządów jamy brzusznej, tomografia klatki piersiowej; także badanie EEG. Kluczowe jest dokładne zebranie wywiadu rodzinnego i nierzadko przebadanie pozostałych członków rodziny, mogących posiadać poronną postać choroby.
Obecnie nie stawia się rozpoznania na podstawie wyników testów genetycznych. Przyczyną jest duża zawodność testów spowodowana mnogością polimorfizmów genów TSC1/TSC2; nie bez znaczenia jest duża rozległość genów, zwiększająca koszt badania. Testy genetyczne mogą być przydatne w potwierdzeniu rozpoznania u chorych niespełniających wystarczających kryteriów rozpoznania klinicznego, a zwłaszcza u małych dzieci, u których część objawów jeszcze się nie rozwinęła. Test może być fałszywie dodatni w przypadku rzadkich allelicznych wariantów genów TSC1/TSC2, albo fałszywie ujemny. Może to prowadzić do groźnego w skutkach wykluczenia choroby u pacjentów ze słabo wyrażonymi objawami.
Testy genetyczne są także podstawą diagnozy prenatalnej stwardnienia guzowatego. Biopsja kosmków łożyskowych w pierwszym trymestrze na równi z echokardiografią serca mogącą wykryć częste już w okresie przedurodzeniowym mięśniaki prążkowanokomórkowe są metodami diagnostycznymi do rozważenia u dziecka kobiety chorej na TSC i (lub) dodatnim wywiadem rodzinnym w kierunku choroby. Niedawne badania wykazały, że ultraszybkie MRI płodu już w 21. tygodniu ciąży może wykryć zmiany w mózgowiu, ale potrzebne są dalsze badania w tym kierunku. W rezonansie magnetycznym i w tomografii komputerowej znaleziskiem mogą być ogniska encefalomalacji w mózgu.
Nie ma patognomonicznych dla TSC objawów, co oznacza, że rozpoznanie musi uwzględniać liczne objawy, często nieuchwytne w niespecjalistycznym badaniu lekarskim. W rozpoznaniu konieczne jest badanie dermatologiczne, neurologiczne, okulistyczne (badanie dna oka), kardiologiczne (echokardiografia) i badania obrazowe – tomografia komputerowa mózgu, tomografia albo USG narządów jamy brzusznej, tomografia klatki piersiowej; także badanie EEG. Kluczowe jest dokładne zebranie wywiadu rodzinnego i nierzadko przebadanie pozostałych członków rodziny, mogących posiadać poronną postać choroby.
Obecnie nie stawia się rozpoznania na podstawie wyników testów genetycznych. Przyczyną jest duża zawodność testów spowodowana mnogością polimorfizmów genów TSC1/TSC2; nie bez znaczenia jest duża rozległość genów, zwiększająca koszt badania. Testy genetyczne mogą być przydatne w potwierdzeniu rozpoznania u chorych niespełniających wystarczających kryteriów rozpoznania klinicznego, a zwłaszcza u małych dzieci, u których część objawów jeszcze się nie rozwinęła. Test może być fałszywie dodatni w przypadku rzadkich allelicznych wariantów genów TSC1/TSC2, albo fałszywie ujemny. Może to prowadzić do groźnego w skutkach wykluczenia choroby u pacjentów ze słabo wyrażonymi objawami.
Testy genetyczne są także podstawą diagnozy prenatalnej stwardnienia guzowatego. Biopsja kosmków łożyskowych w pierwszym trymestrze na równi z echokardiografią serca mogącą wykryć częste już w okresie przedurodzeniowym mięśniaki prążkowanokomórkowe są metodami diagnostycznymi do rozważenia u dziecka kobiety chorej na TSC i (lub) dodatnim wywiadem rodzinnym w kierunku choroby. Niedawne badania wykazały, że ultraszybkie MRI płodu już w 21. tygodniu ciąży może wykryć zmiany w mózgowiu, ale potrzebne są dalsze badania w tym kierunku. W rezonansie magnetycznym i w tomografii komputerowej znaleziskiem mogą być ogniska encefalomalacji w mózgu.
Aktualnie obowiązujące kryteria diagnostyczne zostały przygotowane przez International Tuberous Sclerosis Complex Consensus Group w 2012 roku i opublikowane rok później. Poza kryteriami klinicznymi, w dużej mierze analogicznymi do zaproponowanych w 1998 r., wprowadzono również kryterium genetyczne. Stwierdzenie patogennej mutacji genu TSC 1 lub TSC 2 umożliwia postawienie rozpoznania stwardnienia guzowatego.
Diagnostyka preimplantacyjna
Diagnostyka preimplantacyjna (PGD) jest to technologia umożliwiająca wykrycie i zidentyfikowanie mutacji genetycznych w genomie zarodka powstałego dzięki technikom wspomaganego rozrodu jeszcze przed jego implantacją (zagnieżdżeniem) w jamie macicy matki. Dzięki PGD implantowane zostaną jedynie te zarodki, które pozbawione są danej wady genetycznej, co zwiększa szanse na prawidłową ciążę, donoszenie jej i urodzenie zdrowego dziecka.
Ogólne postępowanie w przypadku badania wykrywającego choroby jednogenowe, takie jak stwardnienie guzowate, polega na pobraniu jednej komórki zarodka, namnożeniu materiału genetycznego dzięki technice PCR i zhybrydyzowaniu uzyskanego materiału z sondami molekularnymi wykrywającymi badaną mutację. Istnieje wiele technik wykrywania mutacji powodującej stwardnienie guzowate. Konkretna metoda zależy od ośrodka, w którym przeprowadzane jest badanie.
Jeżeli badanie będzie negatywne, zarodek jest implantowany do jamy macicy matki.
Ogólne postępowanie w przypadku badania wykrywającego choroby jednogenowe, takie jak stwardnienie guzowate, polega na pobraniu jednej komórki zarodka, namnożeniu materiału genetycznego dzięki technice PCR i zhybrydyzowaniu uzyskanego materiału z sondami molekularnymi wykrywającymi badaną mutację. Istnieje wiele technik wykrywania mutacji powodującej stwardnienie guzowate. Konkretna metoda zależy od ośrodka, w którym przeprowadzane jest badanie.
Jeżeli badanie będzie negatywne, zarodek jest implantowany do jamy macicy matki.
Różnicowanie
W przypadku stwierdzenia przynajmniej dwóch zmian w różnych narządach, co zwykle spełnia kryteria rozpoznania i potwierdza diagnozę, różnicowanie jest zbędne. Natomiast niemal każda z szerokiego spektrum zmian narządowych w stwardnieniu guzowatym może występować jako zmiana izolowana. Szczególną trudność sprawić może różnicowanie trądziku młodzieńczego u starszych dzieci z opóźnieniem umysłowym i (lub) padaczką, zwłaszcza że zmiany w ośrodkowym układzie nerwowym występują u większości chorych z padaczką. Trudności diagnostyczne sprawiają poronne postaci choroby u bliskich krewnych osoby chorej na TSC, wymagające skrupulatnego badania fizykalnego wykluczającego lub potwierdzającego chorobę; testy genetyczne mogą pomóc, szczególnie jeśli znane jest dokładne miejsce mutacji u probanta.
Zwapnienia okołokomorowe należy różnicować ze zwapnieniami powstającymi w przebiegu toksoplazmozy i cytomegalii; pomocne jest oznaczenie poziomu odpowiednich przeciwciał. Angiofibromata twarzy występują też w zespole mnogiej gruczolakowatości wewnątrzwydzielniczej typu 1.
Zwapnienia okołokomorowe należy różnicować ze zwapnieniami powstającymi w przebiegu toksoplazmozy i cytomegalii; pomocne jest oznaczenie poziomu odpowiednich przeciwciał. Angiofibromata twarzy występują też w zespole mnogiej gruczolakowatości wewnątrzwydzielniczej typu 1.
Leczenie
Historia leczenia stwardnienia guzowatego
Sukcesy w leczeniu pacjentów z TSC pojawiły się znacznie później. Pionierską operację usunięcia guzów kory mózgowej u siedmiu pacjentów z TSC przeprowadzili w 1966 roku Phanor Perot i Bryce Weir. W dwóch przypadkach udało się usunąć ognisko padaczkowe. Mimo tego sukcesu do dziś jedynie kilku pacjentów ze stwardnieniem guzowatym zostało poddanych takiemu chirurgicznemu leczeniu. W 1979 roku ukazała się klasyczna monografia Manuela Gómeza (1928-2006) „Tuberous Sclerosis”, systematyzująca wiedzę zdobytą w przeciągu blisko stu lat. Gomez podał też pierwsze kryteria diagnostyczne TSC. W 2002 roku podjęto pierwsze próby kliniczne terapii pacjentów z TSC rapamycyną.
Obecne możliwości leczenia
Leczenie chorych ze stwardnieniem guzowatym jest objawowe i polega na chirurgicznym usuwaniu guzów złośliwych i podawaniu leków przeciwpadaczkowych. Zalecenia terapeutyczne dla poszczególnych zmian narządowych wymienione są w tabelce. Zaleca się również usuwanie zmian skórnych na twarzy, które nie są obarczone ryzykiem zezłośliwienia, ale wywierają niekorzystny wpływ na psychikę dziecka (reakcje depresyjne). Metodą z wyboru jest laseroterapia. Leczenie padaczki w TSC jest szczególnie trudne; napady są często oporne na działanie wielu leków. W napadach zgięciowych najlepsze wyniki uzyskuje się leczeniem wigabatryną lub syntetycznymi preparatami ACTH.
Na etapie badań klinicznych są próby leczenia naczyniakomięśniakotłuszczaków, gwiaździaków i limfangioleiomiomatozy przy użyciu rapamycyny (Sirolimus). Wyniki określa się jako obiecujące. W 2008 roku opublikowano pracę, w której u pacjentów z TSC leczonych sirolimusem stwierdzono zmniejszenie wielkości naczyniakomięśniakotłuszczaków i poprawę parametrów spirometrycznych u pacjentów z LAM. AML miały tendencję do zwiększania objętości po zaprzestaniu terapii. Dalsze, randomizowane badania przeprowadzone na dużych grupach chorych, oceniały inny lek z grupy inhibitorów mTOR - ewerolimus. Rezultaty badania EXIST-1 i EXIST-2 doprowadziły do rejestracji leku w terapii guzów mózgu SEGA, które nie kwalifikują się do leczenia operacyjnego oraz terapii guzów AML nerek. Podobnie jak w przypadku rapamycyny, pozytywny efekt utrzymuje się w czasie podawania leku. Przerwanie leczenia powoduje w ciągu kilku miesięcy ponowny wzrost guza. Podawanie inhibitorów mTOR wywiera prawdopodobnie pozytywny wpływ na wszystkie aspekty stwardnienia guzowatego. Aktualnie badany jest wpływ tej formy terapii na napady padaczkowe i zaburzenia zachowania u chorych.
Dynamicznym zmianom podlega podejście do leczenia padaczki. Wstępne doniesienia naukowe wskazują, że podawanie chorym wigabatryny przed ujawnieniem się napadów, już na etapie stwierdzenia pierwszych nieprawidłowości w zapisie EEG, istotnie zmniejsza prawdopodobieństwo wystąpienia w przyszłości ciężkich powikłań, takich jak upośledzenie umysłowe. Obserwacje te legły u podstaw projektu naukowego EPISTOP koordynowanego przez Klinikę Neurologii, Epileptologii i Rehabilitacji Pediatrycznej Instytutu „Pomnik – Centrum Zdrowia Dziecka” w Warszawie. Jednym z celów projektu EPISTOP będzie potwierdzenie, że podawanie leków przeciwpadaczkowych już na etapie pojawienia się aktywnych zmian w zapisie EEG zwiększa skuteczność leczenia padaczki i znacznie zmniejsza jej lekooporność, a także w dużym stopniu zapobiega opóźnieniu umysłowemu. Drugim celem jest znalezienie tzw. biomarkerów rozwoju padaczki, czyli cząsteczek, które biorą udział w epileptogenezie.
| Zmiany narządowe lub ogólne | Zalecane leczenie | Uwagi |
|---|---|---|
| Padaczka | Leki przeciwpadaczkowe, ewentualnie leczenie chirurgiczne (resekcja ogniska padaczkowego), stymulacja nerwu błędnego | |
| Gwiaździak podwyściółkowy olbrzymiokomórkowy | Leczenie chirurgiczne, w tym leczenie wodogłowia, jeśli wystąpi | Radioterapia po resekcji jest zwykle przeciwwskazana – stwierdzono ryzyko rozwoju glioblastoma |
| Upośledzenie rozwoju psychicznego | Pomoc psychologiczna i psychiatryczna, edukacja w szkole specjalnej | |
| Zmiany skórne | Laseroterapia naczyniakowłókniaków twarzy, wycięcie włókniaków okołopaznokciowych | Włókniaki okołopaznokciowe często nawracają |
| Guzki siatkówki | Rzadko upośledzają wzrok i na ogół nie wymagają leczenia | |
| Mięśniaki prążkowanokomórkowe serca | Leczenie objawowe zaburzeń rytmu lub niewydolności serca, wskazaniem do leczenia chirurgicznego są guzy wpuklające się do światła komory serca i utrudniające przepływ krwi | |
| Limfangioleiomiomatoza (LAM) | Leczenie hormonalne, transplantacja płuca w schyłkowej LAM | |
| Naczyniakomięśniakotłuszczaki nerek (AML) | Leczenie chirurgiczne wskazane w przypadku krwawienia, stosuje się embolizację tętnicy lub częściową nefrektomię | Należy dążyć do uniknięcia nefrektomii kiedy tylko jest to możliwe |
| Wielotorbielowatość nerek | Leczenie objawowe niewydolności nerek | Wymaga dokładnego monitorowania czynności nerek i ciśnienia tętniczego |
| Gruczolaki łojowe | Zamraża się płynnym azotem, a większe zmiany można usuwać chirurgicznie lub za pomocą lasera |
Zalecenia
Zalecane badania diagnostyczne u chorych z TSC według National Tuberous Sclerosis Association:
| Rodzaj badania | Pierwsze badanie | Kolejne badania |
|---|---|---|
| Ocena neurorozwojowa | Przy rozpoznaniu | Jeśli będą wskazania |
| Badanie okulistyczne | Przy rozpoznaniu | Jeśli będą wskazania |
| EEG | W razie wystąpienia drgawek | Jeśli będą wskazania (przy leczeniu przeciwpadaczkowym) |
| EKG | Przy rozpoznaniu | Jeśli będą wskazania |
| ECHO serca | Przy rozpoznaniu | W przypadku stwierdzenia mięśniaków prążkowanokomórkowych serca co 2-3 lata i zawsze w razie wystąpienia objawów kardiologicznych |
| USG nerek | Przy rozpoznaniu | Co 1-3 lata |
| CT klatki piersiowej | U dorosłych kobiet | Gdy występują objawy ze strony układu oddechowego |
| CT głowy | Przy rozpoznaniu | Co 1-3 lata u dzieci i młodzieży |
Rokowanie
Rokowanie u chorych z TSC zależy od ciężkości choroby i czasu jej rozpoznania. Zmiany narządowe u pacjentów ze stwardnieniem guzowatym zwiększają ich śmiertelność, jednak staranna opieka nad chorymi i regularne badania obrazowe pacjentów z rozpoznanym TSC znacznie wydłużyły życie chorych. Nierzadko pacjenci dożywają późnej starości











Brak komentarzy:
Prześlij komentarz